ハードとソフトの両面からGMPの要求事項に適合する施設をご提案します。
高い製品品質を実現するために、建物と設備および装置のハードとソフトの両面から、PIC/S-GMP・cGMP・EUGMP・JGMPなど各レギュレーションの要求事項に適合する施設をご提案いたします。
GMP適合のためのポイント
GMP(Good Manufacturing Practice)とは、医薬品を製造するための要件(守るべきルール)をまとめたものです。
- 【GMPの3原則】
-
- 1.人為的な誤りを最小限にする。(混同、手違いの防止)
- 2.製品に対する汚染および品質変化を防止する。(汚染されていない環境)
- 3.高い品質を保証するシステムを設計する。(恒常的な品質の保証)
日本で医薬品を製造販売することは医薬品医療機器等法(薬機法)で規制されています。医薬の製造業者は「医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令(GMP省令)」を遵守して製造しなければならず、GMPへの適合が製造販売業ならびに製造業の許可要件になっています。日本はPIC/Sに加盟しているためPIC/S‐GMPガイドラインの考え方がGMP省令にも反映されるようになっています。
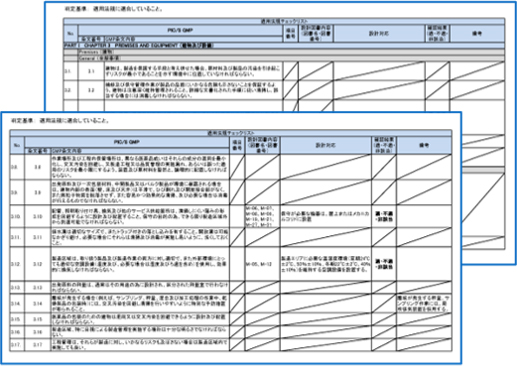
要求事項への適合
各レギュレーションの要求事項に適合するため基本計画段階からチェックリストにより確認していきます。
- PIC/S-GMP
- GUIDE TO GOOD MANUFACTURING PRACTICE FOR MEDICINAL PRODUCTS
- Part I - Basic Requirements for Medicinal Products
- Part II - Basic Requirements for Active Pharmaceutical Ingredients
- Annex
- cGMP
- 21CFR211 Subpart C-Buildings and Facilities(建物と設備)
- 21CFR211 SubpartD-Equipment(装置)